
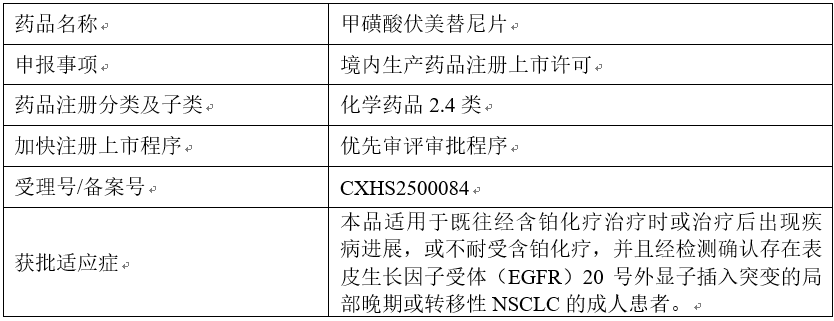
2026年2月3日,近日从中国国家药品监督管理局(NMPA)药品业务应用系统查询获悉,艾力斯自主研发的第三代EGFR TKI艾弗沙®甲磺酸伏美替尼(以下简称:伏美替尼)20号外显子插入突变NSCLC二线治疗适应症药品注册申请的办理环节已更新为“审批完毕-待制证”。本品适用于既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性NSCLC的成人患者。
药品基本情况
EGFR 20号外显子插入突变是非小细胞肺癌(NSCLC)EGFR突变中常见的一种亚型,在我国约占EGFR突变NSCLC患者的2%-5%。目前全球已获批的EGFR-TKI在此类突变的治疗效果不明显且患者预后较差,该治疗领域存在较为迫切的临床需求。
研究数据
截至目前,伏美替尼用于EGFR 20号外显子插入突变经治NSCLC患者的II期临床研究结果显示,确认客观缓解率(ORR)为 44.3%,中位无进展生存期(PFS)为 8.3个月,中位总生存期(OS)为22.9个月,在240mg QD剂量耐受性方面表现良好,未发现新的或意外的安全性信号,具有同类最佳药物(Best-in-class)的潜力。伏美替尼在疗效和安全性方面的优秀表现,有望为EGFR 20号外显子插入突变NSCLC患者带来新的治疗希望。
拓展阅读
伏美替尼是一种表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),为公司自主研发的1类小分子靶向药,其核心化合物专利创新技术(吡啶胺基嘧啶衍生物、其制备方法及应用)已荣获国家知识产权局、世界知识产权组织联合颁授第二十五届中国专利金奖。
伏美替尼适用于EGFR 20号外显子插入突变NSCLC一线及二线治疗适应症在内的多项适应症先后获得国家药品监督管理局(NMPA)药品评审中心(CDE)突破性疗法认定,EGFR 20号外显子插入突变NSCLC一线治疗适应症同时还获得美国食品药品监督管理局(FDA)突破性疗法认定(BTD),多项权威医学指南/共识和诊疗规范,包括《EGFR 20 外显子插入突变非小细胞肺癌规范化诊疗中国专家共识(2024版)》《CSCO 非小细胞肺癌指南(2025 年版)》等,已将伏美替尼共识纳入。
此次伏美替尼EGFR 20号外显子插入突变NSCLC二线治疗适应症上市申请完成审批,意味着伏美替尼覆盖患者群体的持续拓展,将进一步增强产品的临床应用价值与市场可及性。公司将不断深化专业学术推广,积极推动新增获批适应症尽快纳入国家医保目录,以期惠及更多肺癌患者。
关于艾弗沙®
伏美替尼是中国原研、具有自主知识产权的第三代EGFR-TKI,分别于2021年3月、2022年6月获批EGFR突变的局部晚期或转移性NSCLC成人患者的二线、一线治疗适应症,并均已被纳入国家医保目录。2021年6月艾力斯与ArriVent Biopharma, Inc. 达成伏美替尼海外独家授权合作,目前伏美替尼针对EGFR 20号外显子插入突变NSCLC患者一线治疗适应症的包括中国、美国、英国、法国、日本、韩国等多个国家在内的全球多中心III期注册临床研究正在顺利进行中。此外,伏美替尼针对EGFR 20号外显子插入突变NSCLC治疗的适应症获得中、美监管机构的突破性疗法认定;针对NSCLC EGFR敏感突变辅助治疗、PACC 突变NSCLC一线治疗、EGFR 敏感突变NSCLC伴脑转移患者治疗、EGFR非经典突变辅助治疗的注册临床研究也在顺利推进中。
关于艾力斯
上海艾力斯医药科技股份有限公司成立于2004年3月,是一家以全球医药市场需求为导向,专注于肿瘤治疗领域,集新药研发、生产和商业化为一体的创新型制药企业。艾力斯医药以科技关爱生命为发展理念,以开发首创药物和同类最佳药物为首要目标。历经20多年坚持不懈的努力,艾力斯已经成功自主研发,获批多款创新药,具备持续创制具有自主产权的、疗效确切的抗肿瘤新药之综合实力。2020年12月2日,上海艾力斯医药科技股份有限公司正式在上海证券交易所科创板挂牌上市(股票代码:688578)。

